에티오피아에서 외국산 의약·의료용품을 판매할 경우에는 우선적으로 에티오피아 식품 의약처(EFDA: Ethiopian Food and Drug Administration)에 제품 등록을 신청해야 합니다. EFDA는 전자규제정보시스템 (eRIS)을 활용해 여러 국가의 다양한 공급 업체를 대상으로 의약품 및 식료품에 대한 판매 및 허가 승인을 감독합니다. EFDA가 발간한 의약용품과 의약품 제품 등록을 위한 가이드라인의 주요 내용은 다음과 같습니다:
의약용품
식약청에 제출되는 모든 신청서는 영어로 작성된 원본이어야 함. 만약, 포장 라벨링 (package labeling)을 제외한 문서의 다른 부문이 타 언어로 작성되었다면, 원본과 함께 공증을 받은 영문 번역본을 제출해야 함
해당 제품의 제조업자와 에티오피아에서 제품 판매를 담당하는 에이전트 간 계약 필수 (단, 현지 에이전트는 무역부에서 발급한 수입 라이선스를 보유해야 함)
수출국 관계 당국 (National Competent Authority)에 의해 발행된 GMP (Good Manufacturing Practice) 제출 필요
그 외 제품 인증서 (Product Certificate), 기술 문서 (Technical documentation), 포장 라벨링 샘플 등 제출 필요
의약품
위험도가 낮은 제품군을 위한 별도의 가이드라인이 존재. WHO PQ 리스트에 포함된 의약품의 경우 별도의 간소화된 절차를 거침
(해당 리스트는 https://extranet.who.int/prequal/medicines 참조)
의약품 제품 등록의 경우, https://www.eris.efda.gov.et/ 에서 eRIS를 통한 온라인 신청서 제출만 허용되며, 모든 파일은 pdf 형태로 제출되어야 함
등록 심사 결과는 신청 후 90일 내로 통보됨
패스트 트랙 등록 (Fast Track Registration): 항말리아제, 결핵 치료제, 산모/신생아/모자보건 (MNCH) 제품, 항암 치료제, 백신, 간염 치료제, 신약, 희귀 질환 치료제 및 인도적 지원을 위한 의약품은 제품 평가 및 등록에 있어 우선순위를 지님
문서 양식은 본 가이드라인에 언급된 국제공통기술문서 (CTD, Common Technical Document)의 형식을 따라야 함
모든 해외 의약품 제조업자들은 의약품 등록 절차를 시작하기 위해 에티오피아에 실제 거주하고 있는 현지 에이전트 혹은 담당자를 지정하고, 첨부된 양식의 계약서를 작성해야 함
수출국의 관계 당국이 발행한 GMP (Good Manufacturing Practice), 완제의약품 (FPP, Finished Pharmaceutical Product) 제조업체의 제조 허가증, FPP 인증서 사본 제출 필요.
그 외, 제품 포장지와 의약품 첨부 문서 등을 포함한 제품 정보 제출 필요.
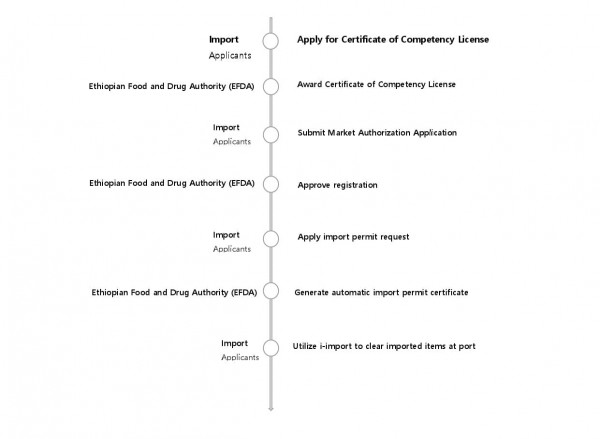
등록 및 통관 절차
i-License에서 Certificate of Competency 신청 → i-Register에서 판매 인허가 신청 → i-Import에서 수입 허가 신청 → 수입허가 증명서 (Import permit certificate)를 활용해 통관 절차 진행
(자세한 내용 및 상세 절차는 https://www.eris.efda.gov.et/를 참고 부탁드립니다)
의약품 및 의약용품 관련 기업 현황
현재 EFDA에 등록된 의약품 및 의약용품 관련 기업들의 현황표는 다음과 같습니다.
분야 |
현황 |
의약품 제조 |
총 11개 (에티오피아 3; 중국 3; 인도 3; UAE 1; 미국 1) |
의약용품 제조 |
총 4개 (중국 2; 에티오피아 2) |
의약용품 수입 |
총 6개 (독일 1) |
의약품 및 의약용품 수입 |
총 33개 (중국 1; UAE 1) |
관련한 보다 자세한 내용 및 양식은 아래의 첨부파일들을 확인 부탁드립니다.
Guidelines_For_Registration_Of_Medical_Devices_or_Supplies
Medicine-Registration-Guideline-4th-edition-May-2020-Ethiopia
Guideline-for-Registration-of-Low-risk-Medicines
Guideline-for-WHO-Pre-qualified-Medicines-through-Collaborative-Registration-Procedure